

 В процессе хранения и эксплуатации изделий из полимеров под действием света, тепла, кислорода может происходить излишне глубокое сшивание макромолекул, которое также является причиной ухудшения свойств полимеров: появляются хрупкость, жесткость, снижается способность к кристаллизации, происходит потеря работоспособности изделий из полимеров.
В процессе хранения и эксплуатации изделий из полимеров под действием света, тепла, кислорода может происходить излишне глубокое сшивание макромолекул, которое также является причиной ухудшения свойств полимеров: появляются хрупкость, жесткость, снижается способность к кристаллизации, происходит потеря работоспособности изделий из полимеров.
Изменение свойств полимеров под действием различных физических и химических факторов в процессе переработки, хранения и эксплуатации изделий из полимеров называется старением.
В реальных условиях полимерные материалы и изделия из них обычно подвергаются комбинированному воздействию различных факторов. Так, только при атмосферном старении, которому подвержены многие материалы и изделия при хранении и эксплуатации, на них одновременно воздействуют свет, тепло, кислород воздуха, перепады температур и т.п. Выявить результат воздействия каждого фактора практически невозможно, что сильно усложняет изучение старения и разработку методов защиты полимеров от вредных воздействий-методов стабилизации полимеров.
Основной способ стабилизации- введение в полимер специальных добавок (стабилизаторов, ингибиторов), замедляющих старение. Роль стабилизаторов сводится либо к предотвращению образования свободных радикалов, либо к взаимодействию молекул стабилизатора с растущими радикалами и переводу их в неактивную форму.
Известно много веществ, используемых в качестве стабилизаторов. В зависимости от назначения стабилизаторов различают антиоксиданты, светостабилизаторы и т.п.
Стабилизаторы, применяемые для замедления окислительной деструкции, называются антиоксидантами. В качестве антиоксидантов используют фенолы, ароматические амины, сульфиды и т.п. Они ингибируют цепной процесс окисления двумя путями: либо обрывают цепь окисления, то есть взаимодействуют со свободными радикалами на стадии их образования(антиоксиданты аминного и фенольного типа), либо предотвращают разложение гидропероксидов по радикальному механизму ( сульфиды, тиофосфаты и т.п.) Антиоксиданты первой группы имеют в молекуле подвижный атом водорода, энергия связи которого с углеродом меньше, чем энергия связи подвижного атома водорода в полимере. Поэтому гидропероксидный радикал легче вступает в реакцию с ингибитором, чем с полимером. Образующиеся при этом свободные радикалы ингибитора малоактивны и не могут вызвать продолжение цепи радикальных реакций. В процессе окисления ингибитор расходуется, а часть его присоединяется к полимеру.
Реакции ингибированного окисления можно представить следующим образом(InH- молекула ингибитора):
ROO· +InH→ROOH+In·
R·+InH→RH+In·
ROO·+In·→ROOIn
R·+In·→RIn
In·+In·→In-In
Таким образом, действие ингибиторов состоит в обрыве реакционной цепи окисления по реакциям (1) и (2). Образующийся радикал ингибитора малоактивен и не способен оторвать водород от молекулы полимера. Он дезактивируется сам или дезактивирует полимерные радикалы по реакциям (3-5). В качестве ингибиторов окисления( антиоксидантов) используются соединения относящиеся к классу вторичных ароматических аминов, фенолов, бисфенолов, фенолсульфидов, содержащие подвижный атом водорода. Большое распространение получили такие антиоксиданты как ионол(2,6- ди-трет-бутил-4-метилфенол) и неозон Д (N-фенил-β-нафтиламин).
Антиоксиданты второй группы ( сульфиды, тиофосфаты, дитиокарбаматы) разлагают гидропероксиды с образованием стабильных молекулярных соединений:
ROOH+R'-S-R'→ROH+R'-SO-R'
Особенно эффективна стабилизация полимеров смесями антиоксидантов, называемых синергетическими смесями.
Антиоксиданты тормозят окисление только в том случае, когда их концентрация в полимере не превышает определенное значение, называемое критической концентрацией.
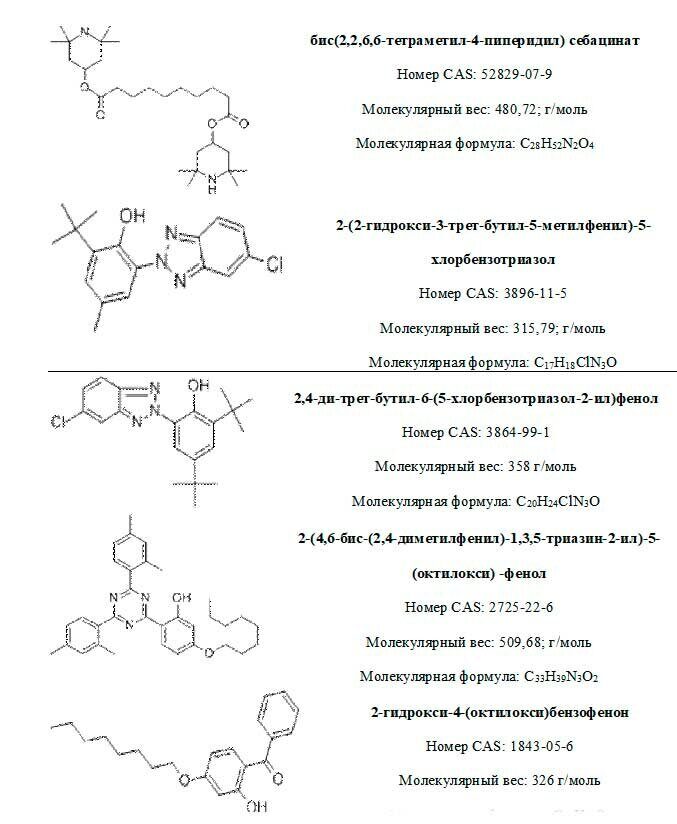
Стабилизация полимеров к фотохимической деструкции основана на введении в полимер соединений, которые легко поглощают световую энергию и трансформируют ее так, что она становится безопасной для полимера. В качестве фотостабилизаторов применяют неорганические и органические соединения, отражающие или поглощающие ультрафиолетовое излучение. К ним относятся неорганические пигменты, в первую очередь оксиды различных металлов, например оксид цинка, который является очень эффективным фотостабилизатором для области светового излучения с длиной волны от 240до 380нм. В качестве светостабилизаторов также применяют производные салициловой кислоты (для эфиров целлюлозы, поливинилхлорида, полиолефинов), бензотриазолы( для полистирола, полиэтилентерефталата, полиолефинов), производные бензофенона( для полиолефинов, полистирола, поливинилхлорида, полиэтиленоксидов, полиэтилентерефталатов).
Светостабилизаторы на основе металлорганических соединений могут взаимодействовать с образующимися при деструкции свободными радикалами и гидропероксидами.
Эффективным светостабилизатором для многих полимеров служит газовый канальный технический углерод(2-5масс% от массы полимера). Наибольший эффект дает совместное применение технического углерода и некоторых антиоксидантов. Технический углерод широко применяется для защиты полиэтиленовых изделий черного цвета-труб, мульчирующей пленки для сельского хозяйства, деталей машин.
Возможности термической стабилизации полимеров ограничены, так как в температурном интервале 250-3000С распадаются не только полимеры, но и стабилизаторы. Исключением является поливинилхлорид. Из-за чрезмерно малой термической стойкости и окрашивания на самой ранней стадии обработки переработка этого полимера без стабилизатора невозможна. Стабилизаторы поливинилхлорида должны удовлетворять следующим требованиям: связывать хлороводород, который катализирует процесс дегидрохлорирования, замещать аномально подвижные атомы хлора в основной цепи, разрушать полиеновые последовательности, вызывающие окраску полимера. Наиболее широкое распространение в качестве стабилизаторов поливинилхлорида получили стеараты некоторых металлов, например бария, кадмия( часто их используют совместно в качестве синергической смеси).
Стеарат бария связывает хлороводород:
(С17H35COO)2Ba+HCl→ C17H35COOH+C17H35COOClBa
Стеариновая кислота гораздо слабее соляной и поэтому не ускоряет реакцию дегидрохлорирования. Подвижные атомы хлора в основной цепи замещаются на кислотный остаток также в результате обменной реакции, но уже со стеаратом кадмия:
−CH2-CHCl-CH-CH− + (C17H35COO)2Cd→-CH2-CH(OCOC17H35)-CH-CH− +C17H35COOClCd
Аналогичным образом связывая HCl и замещая подвижные атомы хлора в цепи, действуют в качестве стабилизаторов смешанные оловоорганические соединения общей формулы R2SnX2 где R-алкил, X-галоген.
Примеры стабилизаторов

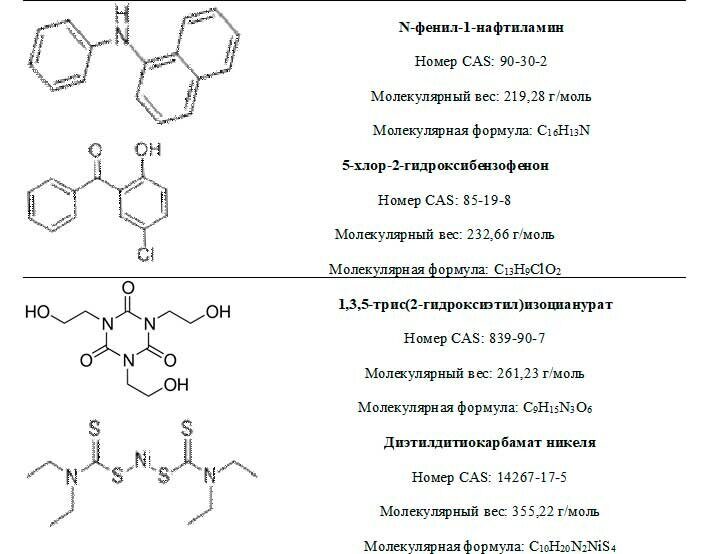
УФ-поглотители

материал www.chemanalytica.ru