ключевые слова: Ионообменная смола, очистка воды, катиониты, катионит, емкость катионита, обменная емкость катионита, регенерация катионита, катиониты и аниониты, смола катионит, регенерация ионитов, свойства ионитов , характеристики ионитов, ионный обмен иониты, виды ионитов, ионитам называли, иониты используют для, ионный обмен очистка воды, очистка воды методом ионного обмена, установка ионного обмена +для очистки воды
Ионный обмен — наиболее распространенный метод очистки воды. Иониты (ионообменники) — это вещества в виде гранул или волокон, способные обменивать свои ионы на ионы внешней среды ( ионы воды).
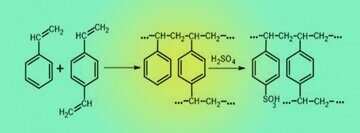
В 1905 году немецкий химик Ганс использовал синтетические алюмосиликатные материалы, известные как цеолиты, в первых ионообменных смягчителях воды. Разработка катионообменной среды из сульфированного угля, позволила снизить щелочность и жесткость воды и расширила применение ионного обмена в водоподготовке. В середине 1940-х годов были разработаны ионообменные смолы на основе сополимеризации стирола, сшитого с дивинилбензолом. Сульфированием полистирола в 1945 г. Д’Алелио получил сильнокислотный сульфокатионообменник , а Мак Барни в 1952 г. аминированием полистирола синтезировал высокоосновный анионообменник .
Схема синтеза сильнокислотного полистирольного сульфокатионообменника
Эти смолы были очень стабильны и обладали гораздо большей обменной способностью, чем их предшественники. Это нововведение сделало возможной полную деминерализацию воды, получение особо-чистой воды.
Полистирол-дивинилбензольные смолы до сих пор используются в большинстве решений для ионного обмена. Хотя основные компоненты смолы одинаковы, смолы могут быть модифицированы различными способами в зависимости от конкретной задачи и сферы применения. В дополнение к пластиковой матрице ионообменная смола содержит ионизируемые функциональные группы. Эти функциональные группы состоят как из положительно заряженных катионных элементов, так и из отрицательно заряженных анионных элементов. Однако только одна из ионных разновидностей подвижна. Другая ионная группа присоединена к структуре гранул.
Классификация ионитов.
Иониты подразделяются на катиониты и аниониты, обменивающие соответственно положительно или отрицательно заряженные ионы, и амфолиты, способные обменивать одновременно и те, и другие ионы. Чаще всего используются синтетические органические иониты — ионообменные смолы, поскольку они обладают максимальной обменной емкостью. В состав ионитов входят различные функциональные группы, способные к ионному обмену. Большая часть промышленных катионитов содержит сульфогруппы [–SO3 –], анионитов — группы четвертичных аммониевых оснований, например [–(CH3)3N+-]. В зависимости от степени диссоциации катионообменные смолы бывают: сильно- и слабокислотные; анионообменные – сильно- и слабоосновные.
Сильнокислотные: катиониты, содержащие группы (SO3H);[PO(OH)2].
Слабокислотные: катиониты, содержащие группы (COOH); (C6H5OH).
Сильноосновные: аниониты, содержащие группы (R3NOH);
Слабоосновные: аниониты, содержащие группы различной степени замещения (−NH2; =NH; ≡N).
Иониты, содержащие одинаковые активные группы, называются многофункциональными, а иониты, содержащие функциональные группы различной химической природы – полифункциональными.
В маркировке смол для ионитов употребляют:
- для катионитов – букву К;
- для анионитов – букву А.
В обозначении анионитов после «А», «В» - высокоосновный, «Н» - низкоосновный.
Числовое обозначение – порядковый номер производственной серии.
Например:
АВ – анионит высокоосновный;
АН – анионит низкоосновный;
КУ – катионит универсальный;
КФ – катионит фосфорнокислый.
Применение ионного обмена в водоподготовке.
Ионный обмен широко используется для деминерализации воды. Для умягчения воды воды достаточно всего лишь поменять в ней ионы (кальция, магния) на ионы водорода:
2RSO3–H++Ca2+ → (RSO3–)2Ca2+ + 2H+.
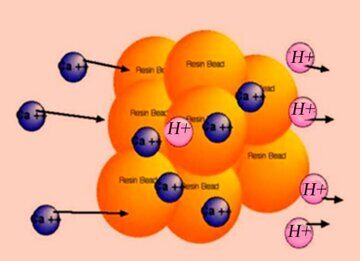
Реакция протекает за счет различия химических потенциалов в фазе ионита и в растворе электролита(воды). Скорость установления равновесия может лимитироваться одной из стадий ионного обмена:
1.диффузия ионов в растворе к поверхности зерна ионита.
2.диффузия ионов внутри зерна.
3.протекания реакции обмена ионов.
4. диффузия вытесненных ионов внутри зерна к поверхности зерна.
5. диффузия ионов с поверхности зерна ионита в раствор.
На кинетику процесса оказывают влияние: строение ионита, природа ионогенных групп и обменивающихся ионов, размер частиц смолы, температура проведения процесса.
Характеристика основных марок отечественных катионитов, выпускаемых для нужд водоподготовки:
|
Катионит - смола |
Основа матрицы |
Сшивающий агент |
Функциональная группа |
Ионная форма |
Кислотность |
|
|
Марка |
Тип |
|||||
|
КУ-2 |
Полимеризационная |
Полистирол |
Дивинл-бензол, 8 – 10 % |
SO3H |
H+ Na+ |
Сильнокислотный |
|
КУ-2-8 |
То же |
То же |
То же |
То же |
То же |
То же |
|
КУ-1 |
Конденсационная |
Фенолоформальдегидная |
- |
SO3H |
H+
|
Сильнокислотный |
|
КФ-1 |
Полимеризационная |
Полистирол |
- |
PO(OH)2 |
Na+ |
Среднекислотный |
|
КБ-1 |
Полимеризационная |
Метакриловая кислота |
- |
COOH |
Na+ |
Слабокислотный |
Характеристика основных марок анионитов, выпускаемых для нужд водоподготовки:
|
Анионит
|
Основа матрицы |
Сшивающий агент |
Функциональная группа |
основность |
|
|
марка |
тип |
||||
|
АВ-17 |
полимеризационный |
Полистирол |
Дивинилбензол 8% |
R3N+ |
Сильноосновный |
|
ЭДЭ-10Д |
То же |
Эпоксиполиамин |
- |
RNH, R2N,R3N+(10-20%) |
Промежуточно-основный |
|
АН-22 |
То же |
Полистирол |
Дивинилбензол |
NH2,RNH |
Слабоосновный |
|
АН-31 |
Конденсационный |
Полиэтилен- полиамин |
Эпихлоргидрин |
RNH, R2N |
Слабоосновный |
|
АН-2Ф |
То же |
Полиэтилен-полиамин |
- |
RNH, R2N |
слабоосновный |
Обменная емкость смолы и регенерация ионитов.
Вся смола имеет конечную обменную способность. Емкость смолы показывает количество ионов, которое может быть сорбировано ионитом, и выражается обычно в мг-экв на 1 г ионита (удельная емкость) или на 1 см3 ионита в набухшем состоянии (объемная емкость). Следует различать полную обменную емкость и равновесную обменную емкость, которая соответствует конкретным рабочим условиям и служит основой для выбора ионообменной смолы. Удельная емкость органических ионообменных материалов достигает нескольких мг-экв на 1 г смолы. От типа и жесткости структуры смолы и количества ионогенных групп зависит степень набухания ионита и, следовательно, его обменная емкость. Обычно промышленные образцы ионитов увеличивают свой объем при набухании в 1,5-3 раза. После того, как центры обмена на гранулах смолы в конечном итоге заполнятся и не смогут обмениваться с катионами кальция и магния, требуется регенерация.
Регенерация катионита проводится обработкой раствором кислоты:
(RSO3 –)2Ca2+ + 2H+ = 2RSO3 –H+ + Ca2+
Как правило, две ионообменные колонки работают в паре. В одной происходит рабочий процесс, в другой — регенерация катионита. Аналогичным образом проводится освобождение воды от анионов (в анионообменных колонках). Достоинство метода — очень высокая степень очистки (деминерализации) воды. Главный недостаток метода — необходимость регенерации ионитов. Процесс регенерации позволяет многократно использовать одни и те же слои смолы.
Регенерация ионита сложный процесс, требующий использования автоматизированных систем контроля и управления. Кроме того, для регенерации в больших количествах используются химикаты . Непрерывное производство особо чистой воды (20 м3 /ч) при исходном содержании примесей 250 мг/л требует ежедневно от 2 до 3 тонн соляной кислоты и гидроокиси натрия. Масса веществ, сбрасываемых при регенерации ионообменных колонок в сточные воды, примерно на порядок больше, чем масса веществ, извлекаемых из воды.
Изменения состава сырой воды оказывает значительное влияние на качество воды, производимой ионообменной установкой. Хотя большинство подземных вод имеют постоянное качество, состав большинства поверхностных вод со временем сильно меняется. Поэтому необходимо проводить регулярный химический анализ воды, поступающей в ионообменники.
Смола может загрязняться загрязняющими веществами, которые препятствуют процессу обмена, например железом . Трехвалентное железо покрывает катионную смолу, препятствуя обмену. Органически связанное железо проходит через катионный элемент и загрязняет анионную смолу. Марганец, присутствующий в некоторых водах, загрязняет смолу так же, как и железо.
Смолы подвержены микробиологическому загрязнению. Микробиологическое загрязнение может привести к серьезному засорению слоя смолы и даже к механическим повреждениям из-за чрезмерного перепада давления на загрязненной смоле.
Поверхностные воды могут содержать сотни природных и антропогенных органических веществ, в том числе дубильные вещества, дубильную кислоту, гуминовую кислоту и фульвокислоту. Органические вещества блокируют участки на смоле затем они начинают разрушать активные центры смолы, снижая обменную емкость ионитов. Окислители, такие как хлор, разлагают как катионные, так и анионные смолы. Окислители разрушают сшивки дивинилбензола в катионной смоле, снижая общую прочность шарика смолы. По мере продолжения воздействия катионная смола начинает терять свою сферическую форму и жесткость, вызывая ее уплотнение во время эксплуатации, что в свою очередь увеличивает перепад давления в слое смолы и приводит к образованию каналов, что снижает эффективную производительность установки ионного обмена.
ГОСТ 20298-74 Смолы ионообменные. Катиониты. Технические условия.
ГОСТ 20301—74 Смолы ионообменные. Аниониты. Технические условия.
ГОСТ10896-78 Иониты. Подготовка к испытанию.
материал www.chemanalytica.ru




 На химический анализ сточных вод для декларации действует
На химический анализ сточных вод для декларации действует